Credo sia bene premettere subito che un viaggio come quello che stiamo per descrivere e, più in generale, una simile visualizzazione dell’atomo e dei suoi componenti non sarà mai possibile effettuarla realmente. Nessuno strumento potrà mai mostrarci come è fatta una particella (addirittura dovremmo considerare come non-esistenti, da un punto di vista dell’umana idea di esistenza, le particelle sub-atomiche). Una volta il geniale fisico Werner Heisenberg si avvicinò ad una lavagna, durante un convegno, e cancellò la rappresentazione “a sistema solare” di un atomo -nucleo centrale e elettroni che orbitano intorno – affermando che solo le equazioni forniscono un disegno preciso, il resto è superfluo e fuorviante. Quello dei Quanti è un mondo senza luce, senza forme, pur tuttavia innegabilmente vero. Vi è però un modo per ovviare a questo limite scientificamente inviolabile: la nostra fantasia! Uno strumento adattabile a qualsiasi esperimento. Chiedo pertanto venia ai fisici e a tutti gli addetti ai lavori per questa forzatura ma sono, prima di tutto, un sognatore. Non ho saputo resistere.

1 – il nostro inviato Ettore
Siamo pronti, qui dal laboratorio scientifico dell’isola di Laputa, a partire con l’esperimento. Il nostro Ettore, inviato speciale offertosi volontario per la missione, è appena stato miniaturizzato e stiamo per spararlo con un acceleratore verso un atomo di idrogeno, in sospensione in un contenitore stagno.
«Prova. Mi senti Ettore?»
«Sì, confermo. Ricevo forte e chiaro»
«Ettore. Siamo pronti. Dovrai descrivere ogni particolare, ti ricordo che non riusciremo a visualizzare nulla, da qui»
Prepariamoci, sto per premere il pulsante di accensione. Il nostro inviato scorrerà lungo un tubo costituito di magneti, utilizzati per convogliare l’atomo prescelto verso il punto di rendez-vous, ed entrerà all’interno della speciale scatola di contenimento.
«Ettore. 3, 2, 1… via!»
Partito. Da questo momento non avremo modo di tracciare ogni suo singolo spostamento con la precisione necessaria, anche lui sarà soggetto al principio di indeterminazione di Heisenberg (vedi articolo precedente: “Meccanica quantistica sul campo di calcio“), speriamo di non perdere il collegamento vocale.
«Se mi senti, Ettore, direi di fare subito un check»
«Sì, tutto bene. Dà un po’ fastidio essere quasi privo di massa ma almeno perturberò il minimo necessario il nostro obiettivo. Ora sono in uno spazio decisamente quieto, nessun segno di attività energetica»
Il nostro Ettore è stato portato alla massa di 0,05 eV·c-2 (all’incirca la massa presunta del neutrino) assumendo carica neutra, questo per limitare le interazioni con le particelle che incontrerà, dandoci un quadro più o meno esatto della situazione di H (simbolo chimico dell’atomo di idrogeno che andremo a esplorare) al momento del contatto. A questo punto il nostro inviato dovrà inforcare le speciali lenti di cui è dotato, perché i fotoni, particelle responsabili della vista umana e di tutte le altre emissioni elettromagnetiche, saranno all’incirca della sua stessa taglia. Un po’ complicato per loro interagire con i suoi occhi.
«Ettore, cosa osservi in questo istante?»
«Mi sto avvicinando a quella che sembrerebbe una nuvola, o meglio ancora, l’effetto è quello che si ha osservando un nugolo di api che sciamano intorno all’alveare. Credo di essere vicino al guscio orbitale dell’elettrone»
L’atomo di idrogeno è l’atomo “madre”, il più nobile e il più facile da reperire in natura, composto da un solo elettrone orbitante intorno al nucleo. Vi sono tre isotopi (atomi uguali con differente numero di neutroni) di idrogeno: in questo particolare viaggio entreremo in contatto con il Deuterio, l’isotopo composto da un elettrone, un protone e un neutrone. Torniamo a Ettore che si è avvicinato all’orbitale (da non confondersi con orbita intesa come nella meccanica newtoniana. In realtà si tratta di una porzione di spazio in cui la probabilità di reperire un elettrone è alta ma non assoluta) dell’elettrone, descritta da lui come una coltre nebbiosa, quasi una nuvola ma uniformemente solida e distribuita, a causa dell’incredibile velocità e dell’indeterminazione con la quale questa particella si muove intorno al nucleo. Per fare un esempio che potrebbe in qualche modo rendere tutto più chiaro immaginate una matita fatta muovere molto velocemente fra le dita della mano, quando per effetto ottico sembra sventolare con i contorni indefiniti e riempire ogni spazio fra i due estremi del movimento oscillatorio.

2 – Atomo di elio: l’orbita dell’elettrone è una “nuvola” costituita dalle probabili posizioni dell’elettrone.
«Ettore, descrivici qualcosa. Sei vicino all’elettrone?»
«Credo di sì ma potrei anche sbagliare. E’ davvero veloce, riesco solo a percepire l’onda energetica che ogni tanto mi sfiora. Praticamente è ovunque quasi contemporaneamente»
«Riesci a proseguire oltre?»
L’urto con l’elettrone potrebbe provocare l’emissione di particelle. Gli urti generano energia e dato che l’energia è massa e viceversa -come Einstein ha ormai reso noto più di un secolo fa con la sua celeberrima formula- deve fare attenzione, non può correre il rischio di spezzettarsi in elementi ancora più piccoli.
«Davvero, è incredibile. È come trovarsi di fronte all’elica di un aeroplano. Da ferma la sappiamo composta da due pale ma a pieni giri è come se fosse un muro, un pericolosissimo muro»
«Ettore, fai attenzione!»
«Sono passato. Qualcosa -non io spero- ha leggermente perturbato l’orbita dell’elettrone e mi è praticamente passato sopra, senza che io potessi percepire il movimento. Ora è dietro di me, sono all’interno del guscio»
Eccitazioni esterne possono comportare il cambiamento di livello energetico, in questo caso l’elettrone ha acquistato energia allontanandosi dal nucleo. Nel farlo non si è spostato nel nostro comune senso di movimento. Dobbiamo accettare il fatto che ora sia “più indietro” rispetto a poco prima. Immaginando il sistema atomico come una cipolla potremmo affermare che gli spicchi ben distinti corrispondono a orbite elettroniche, e ogni qual volta vi sia una perturbazione tale da variare l’orbita semplicemente ci si riferirà a uno spicchio di cipolla successivo e non a uno “spostamento” vero e proprio di un unico pezzo del vegetale da soffritto.
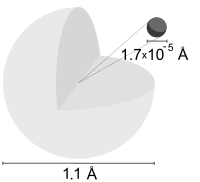
3 – Atomo di idrogeno: l’orbitale elettronico a confronto con il nucleo (non in scala, le misure sono espresse in Ångström: 1Å = 1×10−10 m)
«Bene Ettore, prosegui verso il nucleo allora»
«Sarà dura. C’è un enorme vuoto ora»
Il nucleo di un atomo dista dagli orbitali elettronici dalle 10.000 alle 100.000 volte il raggio del suo nucleo. Se un nucleo fosse grande quanto un uomo alto 1,80 m, l’elettrone più vicino disterebbe circa 20 km.
«Eccolo laggiù, pulsante di energia. Mi avvicino»
Le particelle più macroscopiche e più note, componenti il nucleo sono i protoni e i neutroni. Nello specifico atomo in cui abbiamo inviato Ettore vi sono un protone, con carica positiva (opposta a quella dell’elettrone che è negativa) e un neutrone con carica nulla.
«Sembrano due figure ondulate, all’incirca circolari. Ma non sono “solide”, piuttosto sembra oscillare e intersecarsi come le onde d’acqua che si generano se lanciamo contemporaneamente due sassi in uno stagno, solo che non tendono a diradarsi, qui il movimento è continuo. Provo ad avvicinarmi ancora.»
Il legame che tiene strette le due particelle è dato dalla cosiddetta Forza Nucleare Forte, un risultato dell’enorme energia che tiene insieme i Quark (componenti delle particelle del nucleo, fra poco cercheremo di descriverli tramite Ettore).
«Come uno sciame di formiche, elementi che non saprei come altro definire -informi e mutevoli come macchie di inchiostro che cola- circondano le due particelle.»
«Ettore, confermi quanto dici? Devono essere I gluoni! I gluoni nascono dal cambiamento di colore, termine utilizzato per descrivere lo stato dei Quark…» «Base. Devo interromperti… sta avvenendo qualcosa…»
«Ettore? Ettore?» Il nostro inviato non risponde più.
Cerchiamo di ripristinare il contatto modificando le frequenze… fatto! Dovrebbe funzionare.
«Ettore! Ci ricevi?»
«Eccomi, mi sono dovuto spostare. Qualcosa non va nel contenitore ermetico»
«Cosa intendi? Spiegati meglio, e cerca di non farti male»
«Puoi tranquillizzare gli ascoltatori, sono al sicuro»
Le radio, pur speciali, gracchiano e spezzettano la conversazione, rendendo difficile avere un quadro della situazione.
«Va bene ma spiegaci cosa sta avvenendo»
«C’è stata una specie di onda di energia che mi ha investito. Credo di aver interagito con l’atomo, anche se in forma molto lieve. Mi devo allontanare»
«Bene»
Mentre il nostro inviato si sposta per non influire sulla stabilità atomica riprendiamo per un attimo il concetto di colore dei quark. In tutto sono tre: rosso, blu e verde; gli antiquark si presentano con gli anticolori: antirosso, antiblu e antiverde rappresentati come ciano, magenta e giallo nelle tabelle. I gluoni hanno una mescolanza di due colori, per esempio blu-antirosso, che rappresenta la loro carica di colore. Ovviamente non si parla di colori nel senso che noi tutti attribuiamo al termine, in realtà si tratta di una caratteristica prettamente matematica di queste particelle che viene solo per semplicità indicata in questo modo.
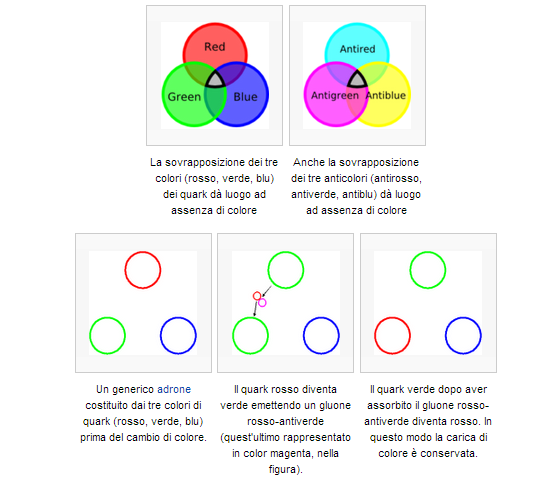
4 – I “colori” dei quark e l’interazione tramite scambio di gluoni
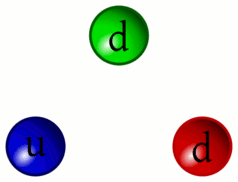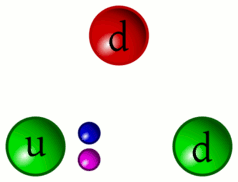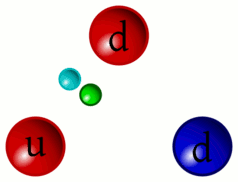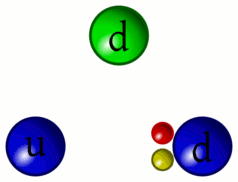
5 – Animazione dell’interazione tra quark
«Riesco a distinguere ancora il continuo pulsare dei Quark. Da questa distanza si può comprendere meglio come i Barioni (particelle formate da tre quark, come i protoni ed i neutroni) siano in realtà la risultanza dell’unione dei tre Quark che li compongono privi di un proprio perimetro definito»
Sì, come per gli addetti ai lavori è ben noto, la necessità di raffigurare in qualche modo gli elementi subatomici ad uso divulgativo e didattico ha comportato l’utilizzo di sfere, palline colorate e oggetti simili. In realtà i protoni e i neutroni sono più simile a delle vibranti amebe piuttosto che a oggetti sferici o comunque solidi.
«Ettore, riesci a distinguere i tipi di quark?»
«Ad occhio sono tutti uguali, purtroppo non v’è modo di riconoscerli»
Ci sono sei tipi di quark, denominati in maniera alquanto fantasiosa: Up, Down – Charm, Strange – Top e Bottom. Essi sono divisi in tre generazioni che variano per la massa crescente dalla prima alla terza. Fra di loro si distinguono per la caratteristica detta sapore che come per il colore non ha nulla dell’accezione “umana” del termine se non che occorreva un termine e questo fu scelto. In realtà il sapore è un numero quantico, ossia l’insieme delle proprietà che descrivono una data particella indicanti i valori delle grandezze fisiche/matematiche.
É ora di far rientrare il nostro coraggioso inviato
«Ettore, sei pronto? Iniziamo la procedura di rientro»
«Sono pronto base. È stato un viaggio emozionante»
«Non preoccuparti, sono sicuro che il pubblico -come me- non vede l’ora di farti ripetere una simile esperienza»
Un saluto a tutti voi, ci rivedremo presto per un altro emozionante viaggio dove “nessuno si è mai spinto prima”.
[hana-code-insert name=’adsense_link’ /]Bibliografia
- Cohen, Jack. Il cuore dell’atomo. Struttura del nucleo. Bologna: Zanichelli, 1968.
(uno degli autori de “La scienza di Mondo Disco”)
- Fermi, Enrico. Atomi nuclei particelle. Scritti divulgativi ed espositivi 1923-1952
a cura di Vittorio Barone. Torino: Bollati Boringhieri, 2009. - Vlatko Vedral, pp. 36-41, Agosto 2011 e Timothy p. Smith, pp. 72-81 Febbraio 2012 in Le Scienze, edizione italiana di Scientific American del Gruppo Editoriale L’Espresso



