Accesso al binario 9 ¾ alla stazione di King’s Cross, Londra: per accedervi bisogna passare attraverso un muro.
(M. Süßen/Commons CC–BY–SA–3.0)
Quanti di noi non hanno sognato le avventure di Harry Potter da quando nel 1997 la Rowling ha pubblicato il primo della serie di libri che hanno avuto tanto successo? Si tratta delle avventure di un mago, Harry Potter appunto, che si inquadrano nella classica disfida tra bene e male. Fin da subito ci si immerge in un mondo fatato grazie al quale si può sognare ad occhi aperti. Certo nessuno si illude più di tanto. Tutti sanno che le motociclette non possono volare, che non è possibile che un essere umano possa inforcare una scopa ed usarla come mezzo di trasporto volante, oppure che gli alberi si muovano o i ragni parlino. Ma più di ogni altra cosa, tutti sanno che non è possibile attraversare i muri come quello che i protagonisti delle storie della Rowling si trovano ad attraversare quando devono prendere il treno per andare nella famosa scuola di Hogwart
.

L’espresso per Hogwart: in realtà è il viadotto Glenfinnan sulla West Highland Line, in Scozia.
(Benutzer:Nicolas17/Commons CC–BY–SA–2.5)
Che noi non possiamo attraversare gli oggetti (ed i muri in particolare) è un fatto acclarato. Se ci provassimo non faremmo altro che procurarci un qualche tipo di trauma. Lo impariamo fin da piccoli quando cominciamo a camminare e cominciamo a dare le prime capocciate ai muri nel tentativo di andare dove non è possibile. Però sarebbe bello poter attraversare un corpo! Si eviterebbero tanti incidenti mortali. Potrebbe essere utile, per esempio, quando si attraversano le strade a Palermo. Lo si farebbe senza patemi, senza temere in ogni istante di essere investito da qualche automobilista indisciplinato (ed a Palermo la media degli automobilisti è indisciplinata!). Fin da quando andiamo a scuola ci viene spiegato che esiste un principio fondamentale della fisica che consiste nella incompenetrabilità dei corpi, ovvero i corpi (oggetti fisici che occupano uno spazio e sono costituiti da massa) non possono penetrare l’uno nell’altro: un corpo può occupare tutto lo spazio possibile eccetto quello occupato da un altro corpo. Sembra un fatto ovvio, cioè del tutto intuitivo: se io sono un oggetto dotato di massa e occupante una porzione di spazio, non posso trovarmi nella porzione di spazio occupata da un altro corpo dotato anche esso di massa. Quello che non ci viene detto a scuola è che la spiegazione del principio di incompenetrabilità dei corpi, benché antichissimo, è stato compreso appieno solo all’inizio del XX secolo.

Lo scrittore francese Marcel Aymé passa attraverso un muro: monumento dedicato al suo romanzo Le passe-muraille (Il passa-mura) a Montmarte, Parigi.
(© Depositphotos)
Cosa è accaduto tra la fine dell’ottocento e la prima metà del ‘900 per permetterci di capire, dopo millenni, il meccanismo alla base della impenetrabilità dei corpi? C’è stata una vera e propria rivoluzione scientifica che oggi conosciamo come “rivoluzione quantistica”, ovvero è nata la meccanica quantistica (MQ). La meccanica quantistica è un complesso insieme di conoscenze attraverso cui si cerca di spiegare il comportamento dei sistemi microscopici. Nasce per opera di un gruppo di scienziati che tutti assieme, ma indipendentemente gli uni dagli altri, realizzarono che le leggi di Newton (che oggi tutti conosciamo come meccanica classica) non erano applicabili nel mondo microscopico. Hertz, Rutheford, Thomson, Bohr, Dirac, Curie, Heisenberg, Schroedinger, de Broglie, Einstein, Born, Planck, Pauli e tanti altri capirono che il comportamento delle particelle a livello microscopico era interpretabile in base a leggi statistiche, ovvero probabilistiche, piuttosto che in base alle leggi deterministiche come quelle elaborate quattro secoli prima da Isaac Newton. Uno dei risultati più eclatanti derivati dalla MQ è stata la comprensione della natura dell’atomo la cui esistenza fu postulata dai filosofi pre-socratici già nel VI secolo a.C: Leucippo, Democrito ed Epicuro. La visione atomistica dei pre-socratici si basava sull’intuizione che un qualsiasi oggetto poteva essere diviso in tante parti. Ognuna di esse poteva essere divisa in più parti e così via di seguito fino al momento in cui le parti ottenute risultavano così piccole da non poter essere più suddivise. Se ci pensiamo bene, questa idea atomica si basava sull’uso del coltello (oggetto con una certa dimensione) che consentiva di dividere un oggetto ad una dimensione non inferiore a quella del coltello stesso. Le parti indivisibili ottenute con coltellini sempre più piccoli, contenevano la “qualità” dell’oggetto sotto analisi. In altre parole, i pre-socratici ritenevano che esistesse una particella prima da cui poi potesse crearsi la materia. In questo modo si distinguevano tantissimi “atomi”: l’atomo della roccia, quello dell’albero, quello del metallo di una spada e così via di seguito. Dopo circa ventisei secoli, il concetto di atomo, così come il numero potenzialmente infinito di essi nella concezione pre-socratica, è stato completamente rielaborato. Oggi è ben noto che il numero di atomi è pari a 118, ovvero quanti sono gli elementi della tavola periodica. Tuttavia, bisogna aggiungere che, di questi, solo una cinquantina sono così stabili da costituire tutta la materia che conosciamo e soltanto cinque/sei sono i più abbondanti sulla Terra (ossigeno in testa).

Atomo di elio: l’orbita dell’elettrone è una “nuvola” costituita dalle probabili posizioni dell’elettrone.
Come è fatto un atomo? L’atomo non è indivisibile. È fatto da subparticelle che si chiamano protoni, neutroni ed elettroni. Queste sono, a loro volta, fatte da altre subparticelle. Tuttavia, per lo scopo prefisso qui, ci fermiamo. Non andiamo oltre. Protoni e neutroni formano un agglomerato che chiamiamo nucleo. Attorno al nucleo ruotano gli elettroni. Il concetto di “ruotare”, in realtà, è sbagliato. Infatti, esso implica un movimento circolare ben definito. Gli elettroni non “ruotano” intorno al nucleo (come viene insegnato erroneamente a scuola) ma si “muovono” intorno ad esso. Come si muovono? Non si sa. Si sa, comunque, che in un dato istante gli elettroni si trovano in una certa porzione di spazio mentre nell’istante successivo possono stare da tutt’altra parte. Come ci sono arrivati? Non si sa. Ecco, se proprio volessimo fare un parallelismo, per quanto ci è dato sapere fino ad ora, gli elettroni sono degli oggetti magici, della stessa magia usata da Harry Potter, che si muovono sparendo e riapparendo in continuazione in uno spazio ben definito intorno al nucleo che abbiamo deciso di chiamare “orbitale”. La magia che consente agli elettroni di comportarsi come descritto si chiama “principio di indeterminazione di Heisenberg”. Cosa dice questo principio? Dice semplicemente che quando passiamo dal macroscopico al microscopico non possiamo conoscere con la stessa precisione sia la posizione che la quantità di moto associata alla particella microscopica.

Werner Karl Heisenberg, premio Nobel per la fisica nel 1932. (Bundesarchiv, Bild183-R57262 / CC-BY-SA 3.0)
La bellezza del principio di Heisenberg sta nel fatto che è grazie ad esso che noi possiamo dire che due atomi differenti sono indistinguibili l’uno dall’altro come due gemelli monozigoti. Anzi, le particelle microscopiche sono ancora più uguali dei gemelli anzidetti. Infatti, benché identici, i gemelli monozigoti hanno tante caratteristiche che ne permettono l’identificazione come, per esempio, impronte digitali o gruppo sanguigno. Invece nel mondo microscopico i gemelli hanno tutto uguale, dal gruppo sanguigno alle impronte digitali. Affinché due oggetti microscopici possano essere differenziati è necessario che ci sia almeno qualcosa che cambi tra loro. Quindi, un atomo di ossigeno è distinto e riconoscibile dall’altrettanto microscopico atomo di azoto perché il primo contiene 8 protoni e 8 elettroni, mentre il secondo contiene 7 protoni e 7 elettroni. La differenza nel numero delle componenti subatomiche fa anche in modo che i due corpi abbiano massa differente. Rimane sempre valido, però, il principio della indistinguibilità microscopica tra sistemi simili: due atomi di ossigeno o due atomi di azoto, così come due elettroni, due protoni o due neutroni sono assolutamente identici, per cui scambiandone la posizione non saremo in grado di dire chi è l’uno e chi è l’altro. Abbiamo appena visto che il principio di indeterminazione ci permette di dire che non esiste differenza tra gli elettroni contenuti in un atomo. Sono tutti uguali ed indistinguibili. Tuttavia, come si dispongono attorno al nucleo? Abbiamo detto che vanno ad occupare uno spazio che si chiama orbitale. Di conseguenza, sulla base di questa unica informazione, ne ricaviamo che in un elemento come il carbonio che ha 6 elettroni, questi ultimi si “affollino” tutti nella stessa porzione di spazio. Molto semplicisticamente, adesso proviamo a pensare ad una stanza di 2 x 2 m nella quale facciamo entrare 6 persone. Le sei persone devono suddividersi uno spazio di 4 m², ovvero hanno circa 0.67 m² ciascuno in cui poter stare. In altre parole, ogni individuo deve stare in un quadrato di circa 80 cm di lato. Un po’ poco direi. Se poi a questo aggiungiamo che le persone si muovono, allungano le braccia, si stiracchiano e fanno tutti quei movimenti che ognuno di noi fa anche senza rendersene conto, ne viene che una stanza di 4 m² non è sufficiente a far star comode sei persone (in realtà non è neanche comoda per una sola persona, ma non è questo il punto adesso).
Adesso immaginiamo che le persone siano gli elettroni del carbonio e la stanza sia l’orbitale di cui abbiamo parlato; aggiungiamo che gli elettroni sono cariche elettriche (negative) tutte uguali e ricordiamo che cariche elettriche dello stesso segno si respingono; ne viene che 6 elettroni assieme non stanno molto bene nella stessa porzione di spazio. Essi tenderanno a starsene solitari e quanto più possibile lontani gli uni dagli altri. In effetti, i cavalieri della meccanica quantistica (già nominati sopra) hanno potuto stabilire il principio dell’Aufbau o della distribuzione elettronica. In base a tale principio, quando un elemento contiene molti elettroni, essi tendono a distribuirsi a distanze diverse dal nucleo occupando spazi (ovvero orbitali) che differiscono tra loro sia per forma che per dimensioni. La cosa interessante, però, è che ogni orbitale non può contenere più di due elettroni. Essi, inoltre, devono essere distinguibili tra loro. Insomma, elettroni uguali in tutto e per tutto non stanno bene assieme nella stessa stanza. Se in base al principio di indeterminazione gli elettroni sono indistinguibili, come mai si è arrivati a dire che un orbitale non può contenere più di due elettroni diversi? Sulla base di cosa riusciamo a distinguere due elettroni? Oltre a carica e massa, gli elettroni hanno anche un’altra proprietà che è stata chiamata spin. Non è facile descrivere lo spin. L’omologia che meglio rende l’idea è quella di un pallone lanciato verso la porta. Il pallone può ruotare in una direzione, per esempio in senso orario, ed avere un effetto che ne sposta la direzione verso destra oppure può ruotare nella direzione opposta, ovvero in senso antiorario, per cui si sposta, nel suo moto, verso sinistra. Ecco. Un elettrone può essere approssimato ad un pallone in rotazione dopo essere stato calciato verso la porta. Può trovarsi in due stati incompatibili tra loro (o ruota in un senso o nell’altro) e nello stesso tempo indistinguibili. L’indistinguibilità di cui si accenna è legata al fatto che fino a che non venga fatta una misurazione diretta, non si può sapere quale dei due elettroni in un orbitale abbia uno spin oppure l’altro. E, comunque, anche quando assegniamo in modo univoco lo spin elettronico, il principio di indeterminazione rimane soddisfatto perché all’atto della misurazione dello spin, non siamo in grado di dire se la posizione dell’elettrone in oggetto (chiamiamola D) sia stata raggiunta lungo il percorso A-D (dove A è la posizione dell’elettrone 1) o lungo il percorso B-D (dove B è la posizione dell’elettrone 2). In altre parole ancora non sappiamo di quale dei due elettroni stiamo misurando lo spin. Sappiamo solo che due elettroni aventi carica e massa uguale non possono avere lo stesso spin se vogliono condividere lo stesso orbitale.
Wolfgang Pauli
La legge dell’Aufbau prevede che un insieme di elettroni occupi tutto lo spazio a disposizione (principio di Hund) in modo tale che nella stessa porzione di spazio (orbitale) non possano coesistere più di due elettroni, distinguibili tra loro per avere spin opposti (principio di Pauli): questo spiega perché quando tentiamo di fare come Harry Potter e corriamo verso un muro, piuttosto che attraversarlo, prendiamo una sonora capocciata. Molto semplicisticamente, attraversare un muro (o un oggetto, in generale) significa che gli orbitali presenti negli atomi che compongono l’oggetto X (il muro) devono sovrapporsi con quelli presenti negli atomi che compongono l’oggetto Y (la nostra testa). Tuttavia, dal momento che tutti gli orbitali sono occupati da una coppia di elettroni con spin opposto, ne viene che sovrapporre un orbitale all’altro implicherebbe generare uno spazio con quattro elettroni a due a due uguali in tutto, incluso lo spin. Questa ultima situazione viola la regola Aufbau e, più in particolare, il principio di Pauli (cuore portante dell’anzidetta regola). Qual è la conclusione? Continuiamo a vedere i film di Harry Potter ed a leggere i libri della Rowling (beneficiando della sospensione dell’incredulità.) Tuttavia, teniamo ben presente che le leggi fisiche inquadrate molto bene dalla quantomeccanica non possono essere violate semplicemente continuando a battere la testa sul muro. In questo caso l’unico risultato possibile è un trauma cranico e un muro scheggiato.
Ad altre puntate la demistificazione di fenomeni che appaiono magici.
Letture consigliate
-
Lederman e Hill
Fisica quantistica per poeti -
Manjit Kumar
Quantum -
Silvia Arroyo Carmejo
Il bizzarro mondo dei quanti
Credo sia bene premettere subito che un viaggio come quello che stiamo per descrivere e, più in generale, una simile visualizzazione dell’atomo e dei suoi componenti non sarà mai possibile effettuarla realmente. Nessuno strumento potrà mai mostrarci come è fatta una particella (addirittura dovremmo considerare come non-esistenti, da un punto di vista dell’umana idea di esistenza, le particelle sub-atomiche). Una volta il geniale fisico Werner Heisenberg si avvicinò ad una lavagna, durante un convegno, e cancellò la rappresentazione “a sistema solare” di un atomo -nucleo centrale e elettroni che orbitano intorno – affermando che solo le equazioni forniscono un disegno preciso, il resto è superfluo e fuorviante. Quello dei Quanti è un mondo senza luce, senza forme, pur tuttavia innegabilmente vero. Vi è però un modo per ovviare a questo limite scientificamente inviolabile: la nostra fantasia! Uno strumento adattabile a qualsiasi esperimento. Chiedo pertanto venia ai fisici e a tutti gli addetti ai lavori per questa forzatura ma sono, prima di tutto, un sognatore. Non ho saputo resistere.

1 – il nostro inviato Ettore
Siamo pronti, qui dal laboratorio scientifico dell’isola di Laputa, a partire con l’esperimento. Il nostro Ettore, inviato speciale offertosi volontario per la missione, è appena stato miniaturizzato e stiamo per spararlo con un acceleratore verso un atomo di idrogeno, in sospensione in un contenitore stagno.
«Prova. Mi senti Ettore?»
«Sì, confermo. Ricevo forte e chiaro»
«Ettore. Siamo pronti. Dovrai descrivere ogni particolare, ti ricordo che non riusciremo a visualizzare nulla, da qui»
Prepariamoci, sto per premere il pulsante di accensione. Il nostro inviato scorrerà lungo un tubo costituito di magneti, utilizzati per convogliare l’atomo prescelto verso il punto di rendez-vous, ed entrerà all’interno della speciale scatola di contenimento.
«Ettore. 3, 2, 1… via!»
Partito. Da questo momento non avremo modo di tracciare ogni suo singolo spostamento con la precisione necessaria, anche lui sarà soggetto al principio di indeterminazione di Heisenberg (vedi articolo precedente: “Meccanica quantistica sul campo di calcio“), speriamo di non perdere il collegamento vocale.
«Se mi senti, Ettore, direi di fare subito un check»
«Sì, tutto bene. Dà un po’ fastidio essere quasi privo di massa ma almeno perturberò il minimo necessario il nostro obiettivo. Ora sono in uno spazio decisamente quieto, nessun segno di attività energetica»
Il nostro Ettore è stato portato alla massa di 0,05 eV·c-2 (all’incirca la massa presunta del neutrino) assumendo carica neutra, questo per limitare le interazioni con le particelle che incontrerà, dandoci un quadro più o meno esatto della situazione di H (simbolo chimico dell’atomo di idrogeno che andremo a esplorare) al momento del contatto. A questo punto il nostro inviato dovrà inforcare le speciali lenti di cui è dotato, perché i fotoni, particelle responsabili della vista umana e di tutte le altre emissioni elettromagnetiche, saranno all’incirca della sua stessa taglia. Un po’ complicato per loro interagire con i suoi occhi.
«Ettore, cosa osservi in questo istante?»
«Mi sto avvicinando a quella che sembrerebbe una nuvola, o meglio ancora, l’effetto è quello che si ha osservando un nugolo di api che sciamano intorno all’alveare. Credo di essere vicino al guscio orbitale dell’elettrone»
L’atomo di idrogeno è l’atomo “madre”, il più nobile e il più facile da reperire in natura, composto da un solo elettrone orbitante intorno al nucleo. Vi sono tre isotopi (atomi uguali con differente numero di neutroni) di idrogeno: in questo particolare viaggio entreremo in contatto con il Deuterio, l’isotopo composto da un elettrone, un protone e un neutrone. Torniamo a Ettore che si è avvicinato all’orbitale (da non confondersi con orbita intesa come nella meccanica newtoniana. In realtà si tratta di una porzione di spazio in cui la probabilità di reperire un elettrone è alta ma non assoluta) dell’elettrone, descritta da lui come una coltre nebbiosa, quasi una nuvola ma uniformemente solida e distribuita, a causa dell’incredibile velocità e dell’indeterminazione con la quale questa particella si muove intorno al nucleo. Per fare un esempio che potrebbe in qualche modo rendere tutto più chiaro immaginate una matita fatta muovere molto velocemente fra le dita della mano, quando per effetto ottico sembra sventolare con i contorni indefiniti e riempire ogni spazio fra i due estremi del movimento oscillatorio.

2 – Atomo di elio: l’orbita dell’elettrone è una “nuvola” costituita dalle probabili posizioni dell’elettrone.
«Ettore, descrivici qualcosa. Sei vicino all’elettrone?»
«Credo di sì ma potrei anche sbagliare. E’ davvero veloce, riesco solo a percepire l’onda energetica che ogni tanto mi sfiora. Praticamente è ovunque quasi contemporaneamente»
«Riesci a proseguire oltre?»
L’urto con l’elettrone potrebbe provocare l’emissione di particelle. Gli urti generano energia e dato che l’energia è massa e viceversa -come Einstein ha ormai reso noto più di un secolo fa con la sua celeberrima formula- deve fare attenzione, non può correre il rischio di spezzettarsi in elementi ancora più piccoli.
«Davvero, è incredibile. È come trovarsi di fronte all’elica di un aeroplano. Da ferma la sappiamo composta da due pale ma a pieni giri è come se fosse un muro, un pericolosissimo muro»
«Ettore, fai attenzione!»
«Sono passato. Qualcosa -non io spero- ha leggermente perturbato l’orbita dell’elettrone e mi è praticamente passato sopra, senza che io potessi percepire il movimento. Ora è dietro di me, sono all’interno del guscio»
Eccitazioni esterne possono comportare il cambiamento di livello energetico, in questo caso l’elettrone ha acquistato energia allontanandosi dal nucleo. Nel farlo non si è spostato nel nostro comune senso di movimento. Dobbiamo accettare il fatto che ora sia “più indietro” rispetto a poco prima. Immaginando il sistema atomico come una cipolla potremmo affermare che gli spicchi ben distinti corrispondono a orbite elettroniche, e ogni qual volta vi sia una perturbazione tale da variare l’orbita semplicemente ci si riferirà a uno spicchio di cipolla successivo e non a uno “spostamento” vero e proprio di un unico pezzo del vegetale da soffritto.
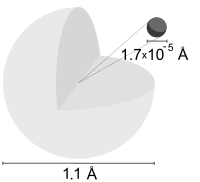
3 – Atomo di idrogeno: l’orbitale elettronico a confronto con il nucleo (non in scala, le misure sono espresse in Ångström: 1Å = 1×10−10 m)
«Bene Ettore, prosegui verso il nucleo allora»
«Sarà dura. C’è un enorme vuoto ora»
Il nucleo di un atomo dista dagli orbitali elettronici dalle 10.000 alle 100.000 volte il raggio del suo nucleo. Se un nucleo fosse grande quanto un uomo alto 1,80 m, l’elettrone più vicino disterebbe circa 20 km.
«Eccolo laggiù, pulsante di energia. Mi avvicino»
Le particelle più macroscopiche e più note, componenti il nucleo sono i protoni e i neutroni. Nello specifico atomo in cui abbiamo inviato Ettore vi sono un protone, con carica positiva (opposta a quella dell’elettrone che è negativa) e un neutrone con carica nulla.
«Sembrano due figure ondulate, all’incirca circolari. Ma non sono “solide”, piuttosto sembra oscillare e intersecarsi come le onde d’acqua che si generano se lanciamo contemporaneamente due sassi in uno stagno, solo che non tendono a diradarsi, qui il movimento è continuo. Provo ad avvicinarmi ancora.»
Il legame che tiene strette le due particelle è dato dalla cosiddetta Forza Nucleare Forte, un risultato dell’enorme energia che tiene insieme i Quark (componenti delle particelle del nucleo, fra poco cercheremo di descriverli tramite Ettore).
«Come uno sciame di formiche, elementi che non saprei come altro definire -informi e mutevoli come macchie di inchiostro che cola- circondano le due particelle.»
«Ettore, confermi quanto dici? Devono essere I gluoni! I gluoni nascono dal cambiamento di colore, termine utilizzato per descrivere lo stato dei Quark…» «Base. Devo interromperti… sta avvenendo qualcosa…»
«Ettore? Ettore?» Il nostro inviato non risponde più.
Cerchiamo di ripristinare il contatto modificando le frequenze… fatto! Dovrebbe funzionare.
«Ettore! Ci ricevi?»
«Eccomi, mi sono dovuto spostare. Qualcosa non va nel contenitore ermetico»
«Cosa intendi? Spiegati meglio, e cerca di non farti male»
«Puoi tranquillizzare gli ascoltatori, sono al sicuro»
Le radio, pur speciali, gracchiano e spezzettano la conversazione, rendendo difficile avere un quadro della situazione.
«Va bene ma spiegaci cosa sta avvenendo»
«C’è stata una specie di onda di energia che mi ha investito. Credo di aver interagito con l’atomo, anche se in forma molto lieve. Mi devo allontanare»
«Bene»
Mentre il nostro inviato si sposta per non influire sulla stabilità atomica riprendiamo per un attimo il concetto di colore dei quark. In tutto sono tre: rosso, blu e verde; gli antiquark si presentano con gli anticolori: antirosso, antiblu e antiverde rappresentati come ciano, magenta e giallo nelle tabelle. I gluoni hanno una mescolanza di due colori, per esempio blu-antirosso, che rappresenta la loro carica di colore. Ovviamente non si parla di colori nel senso che noi tutti attribuiamo al termine, in realtà si tratta di una caratteristica prettamente matematica di queste particelle che viene solo per semplicità indicata in questo modo.
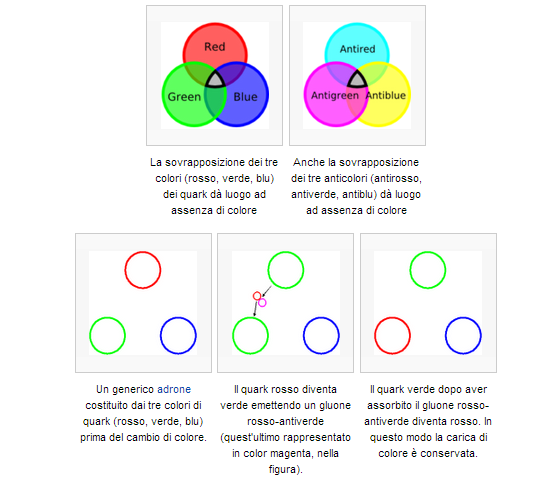
4 – I “colori” dei quark e l’interazione tramite scambio di gluoni
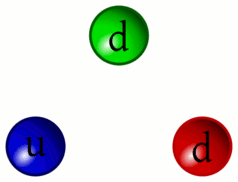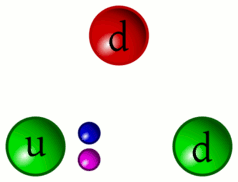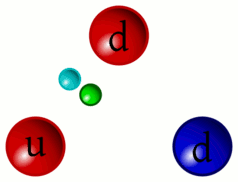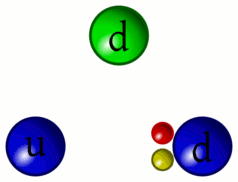
5 – Animazione dell’interazione tra quark
«Riesco a distinguere ancora il continuo pulsare dei Quark. Da questa distanza si può comprendere meglio come i Barioni (particelle formate da tre quark, come i protoni ed i neutroni) siano in realtà la risultanza dell’unione dei tre Quark che li compongono privi di un proprio perimetro definito»
Sì, come per gli addetti ai lavori è ben noto, la necessità di raffigurare in qualche modo gli elementi subatomici ad uso divulgativo e didattico ha comportato l’utilizzo di sfere, palline colorate e oggetti simili. In realtà i protoni e i neutroni sono più simile a delle vibranti amebe piuttosto che a oggetti sferici o comunque solidi.
«Ettore, riesci a distinguere i tipi di quark?»
«Ad occhio sono tutti uguali, purtroppo non v’è modo di riconoscerli»
Ci sono sei tipi di quark, denominati in maniera alquanto fantasiosa: Up, Down – Charm, Strange – Top e Bottom. Essi sono divisi in tre generazioni che variano per la massa crescente dalla prima alla terza. Fra di loro si distinguono per la caratteristica detta sapore che come per il colore non ha nulla dell’accezione “umana” del termine se non che occorreva un termine e questo fu scelto. In realtà il sapore è un numero quantico, ossia l’insieme delle proprietà che descrivono una data particella indicanti i valori delle grandezze fisiche/matematiche.
É ora di far rientrare il nostro coraggioso inviato
«Ettore, sei pronto? Iniziamo la procedura di rientro»
«Sono pronto base. È stato un viaggio emozionante»
«Non preoccuparti, sono sicuro che il pubblico -come me- non vede l’ora di farti ripetere una simile esperienza»
Un saluto a tutti voi, ci rivedremo presto per un altro emozionante viaggio dove “nessuno si è mai spinto prima”.
[hana-code-insert name=’adsense_link’ /]Bibliografia
- Cohen, Jack. Il cuore dell’atomo. Struttura del nucleo. Bologna: Zanichelli, 1968.
(uno degli autori de “La scienza di Mondo Disco”)
- Fermi, Enrico. Atomi nuclei particelle. Scritti divulgativi ed espositivi 1923-1952
a cura di Vittorio Barone. Torino: Bollati Boringhieri, 2009. - Vlatko Vedral, pp. 36-41, Agosto 2011 e Timothy p. Smith, pp. 72-81 Febbraio 2012 in Le Scienze, edizione italiana di Scientific American del Gruppo Editoriale L’Espresso
Immagini
- © Warpedgallerie, Fotolia
- [PD] Commons
- [PD] Commons
- [CC-BY-SA-3.0] Wikipedia
- Krismalac, [CC-BY-SA-3.0] Commons
Definire incomprensibile una disciplina fisica può apparire paradossale, dato che tale scienza dovrebbe spiegare come funziona ogni cosa dell’universo. Eppure la quantistica, pur avendo avuto innumerevoli riprove di solidità teorica e altrettante applicazioni pratiche, rimane ancora un mistero profondo per l’umanità. Nulla, dei principi fondamentali di questa disciplina, può essere infatti descritto nei termini della “fisica classica” o “Newtoniana”.
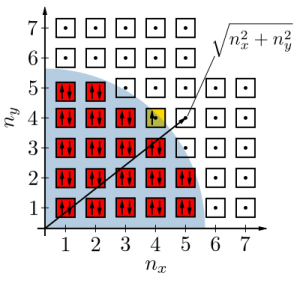
Facciamo un esempio: in un campetto di calcio uno dei nostri amici pone il pallone a terra e sfida il resto della squadra a indovinare il punto esatto dove essa si fermerà dopo averla calciata; la cosa non è semplice da fare ad occhio nudo, non avendo modo di calcolare tutte le variabili fisiche implicate nell’azione. Se l’esperimento venisse effettuato in laboratorio, calcolando attrito del terreno, dell’aria, forza del calcio e altre variabili si arriverebbe a poter stabilire l’esatto punto di arresto. Se il nostro amico, che da adesso in poi chiameremo Ettore per comodità (e tributo al fisico Majorana), rimpicciolisse al punto da poter tirare un calcio ad un elettrone nessun laboratorio potrebbe affermare, a priori, dove questo si andrebbe a fermare. La particella potrebbe benissimo comparire alle spalle dell’ignaro calciatore, o sparire dalla sua vista per sempre. Esistono solo delle probabilità, più o meno esatte, per descrivere il moto sub-atomico e tutte indifferenti ai calcoli circa la forza, il moto, l’arco del calcio di Ettore. L’esempio è ovviamente un gioco mentale, l’elettrone non è calciabile e nemmeno si “fermerebbe” nel senso comune del termine ma pone i presupposti per introdurre la questione principale: la fisica quantistica descrive fenomeni che non hanno corrispondenza con il “reale” percepito da noi uomini quotidianamente. Nulla è, in alcun modo, descrivibile se non attraverso l’uso di esempi che saranno, nella migliore delle ipotesi, semplici proiezioni mentali di esseri abituati al tridimensionale che l’evoluzione ha portato a percepire velocità limitate e uno spettro elettromagnetico minuscolo.
![Brews ohare [CC-BY-SA-3.0] Rappresentazione di un "corpo nero" come oggetto fisico: una cavità nera con un piccolo foro [CC-BY-SA-3.0]](https://www.laputa.it/wp-content/uploads/2013/02/Black-body_realization.png)
2 – Rappresentazione di un “corpo nero” come oggetto fisico: una cavità nera con un piccolo foro.
Il primo principio che sconvolse le menti e gli animi degli scienziati è quello che diede anche il nome alla materia: il quanto. Nel 1900 ogni componente della realtà sembrava essere collocato nel giusto spazio, con leggi e proprietà ben descrivibili finché Max Planck non si trovò a ragionare su un problema che attanagliava le società elettriche di tutto il mondo: «Qual è il miglior materiale per la preparazione di luminarie?» Per rispondere a tale quesito, e per far risparmiare quanto più possibile per i materiali illuminanti, Planck, così come molti altri suoi colleghi prima e contemporaneamente a lui, aveva iniziato a lavorare sul Corpo Nero, un oggetto ideale capace di assorbire completamente la luce e che scaldandosi generava energia e oscillazioni in perfetto equilibrio termodinamico. La classificazione di queste oscillazioni costrinse Planck a quello che lui stesso considerò “un atto di profonda disperazione”. In sostanza si accorse che, contrariamente a quanto fino a quel momento quasi tutti i fisici del mondo ritenevano assodato, l’energia non “fluiva” continua come acqua da un rubinetto, nei processi, ma l’unico modo per poterla determinare era considerarla distribuita in “pacchetti indivisibili”, che lui tra lo stupito e lo sconvolto, denominò quanti (dal latino quantum, quantità). Viene da chiedersi il perché di tanto sconvolgimento, in fondo, detto così sembra che io stia affermando che l’acqua di questo ipotetico rubinetto stia uscendo a spruzzi invece che uniforme, una cosa che può tranquillamente capitare senza che nessuno ne rimanga sorpreso. La questione è leggermente più complessa, nel mondo delle energie. Proviamo con un esempio: Ettore sta attraversando la porta, è un bel ragazzo alto e vestito di jeans e maglietta; siamo tutti d’accordo sulla sua “indivisibilità”, giusto? Ok, se voi foste stati Planck, quella notte del 1900, avreste visto Ettore entrare nella stanza… Un pezzo alla volta ma comunque integro nella sua umanità! Immaginiamo, con molta fantasia, la bocca di Ettore salutare, fluttuante, prima di essere raggiunta dal volto, mentre avanza verso di noi. In pratica pacchetti di Ettore che si muovono senza che esso ne abbia a subire le conseguenze di questa apparente mutilazione.

3 – “Disintegrazione della persistenza della memoria” di Salvador Dalí (1952-54). L’artista, impressionato dalle nuove frontiere della scienza, (note) reinterpretò la propria celebre opera del 1931 “La persistenza della memoria” scomponendo parte della scena in “pacchetti”. (fair use)
La risoluzione della distribuzione elettromagnetica dell’energia di cui Planck si stava occupando gli fece stabilire una costante, h (pari a 6,626×10 -34Js), come approssimazione minima, ma inviolabile, delle caratteristiche del mondo microscopico. In pratica la costante di Planck rese energia, impulso e momento angolare (ossia i parametri di definizione delle particelle subatomiche) quantità multiple (riprendendo Ettore a pezzi di poco prima: bocca, mani, piedi ecc. in sequenza) e mai valori finiti (Ettore intero come un qualsiasi essere umano). Non c’è quindi un fluire costante di energia elettromagnetica definito ma una quantità di pacchetti indivisibili che lo compongono. Agli inizi del ‘900 si era certi dell’esistenza dell’atomo, ora era stata aperta la via per la scoperta e la classificazione dei suoi elementi costitutivi. Le particelle componenti gli atomi e il mondo dell’invisibile erano state dotate di un “vestito” attraverso il quale mostrarsi al mondo. La sensazionale scoperta scosse l’universo della fisica fin nelle sue fondamenta e il periodo che seguì i trent’anni successivi alla nascita della quantistica, fu uno dei più incredibili da un punto di vista scientifico. Menti passate alla storia si ritrovarono a dibattere, studiare, confrontarsi e scontrarsi in un clima di grande fermento e di stimoli altissimi. Einstein, Bohr, Lorentz, de Broglie, Planck, Rutherford, Heisenberg, Schrodinger, per citare qualche nome, personalità che fanno rizzare i peli sulle braccia solo a nominarle, tutti impegnati a cercare di capire l’incredibile mondo degli atomi. In pratica, “trovate” le particelle ora si era in grado di descriverne le azioni e se aver scoperto i quanti ebbe dell’incredibile, quelli che divennero i principi della meccanica quantistica lasciano ancora oggi sbalorditi.
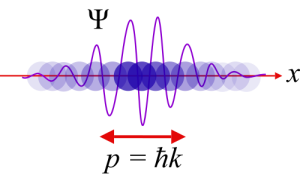
5 – Rappresentazione del dualismo onda-particella
L’introduzione ai principi specifici necessita della rinuncia a qualsiasi tentativo ontologico di comprensione. Sono dei dogmi scientifici su cui soffermarsi cercando una logica è improduttivo. Osserviamo subito il primo aspetto sconcertante: il paradossale rapporto dualistico onda-corpuscolo che contraddistingue le particelle. Gli esperimenti dimostrano che esse sono sia onda di energia che corpo puntiforme dotato di massa. Ettore versione particella in questo momento sarebbe un ologramma a cui si potrebbe stringere la mano, sentendone bene la stretta. Ossia un’immagine (la parte “energia” dell’esempio) ma anche un corpo solido. L’osservazione sperimentale però permette di rilevare solo una delle due forme alla volta, fenomeno questo chiamato Principio di Complementarietà sviluppato da Niels Bohr (1885-1962) e che afferma, in breve, che interagire con le particelle pone fine al loro stato mostrando, all’occasione uno e uno soltanto dei due aspetti.

6 – Werner Heisenberg e Niels Bohr (Fermilab)
Questo ci introduce al secondo principio fondamentale, quello di Indeterminazione di Heisenberg: essendo l’interazione sperimentale in laboratorio “invasiva” la precisione dei valori osservati non sarà mai infinita ma tenderà a diminuire proporzionalmente in uno dei risultati rispetto agli altri: in pratica se volessimo calcolare la posizione di una particella perderemmo informazioni sulla sua quantità di moto e viceversa. Il mondo subatomico ci è precluso nella sua interezza. Torniamo a utilizzare Ettore: gli chiederemo di camminare sopra un asse di legno, poi, bendatici gli occhi andiamo a fare qualche rilevamento: per sapere dove si trova esattamente al tempo X possiamo solo toccarlo, essendo bendati, facendo ciò, però, modificheremo la sua velocità (dovrà rallentare per non cadere giù dall’asse mentre con le mani lo tastiamo) e quindi avremo come dato certo solo la sua posizione. Al contrario se volessimo sapere la sua velocità saremmo costretti a percepire lo spostamento d’aria o il rumore sequenziale dei suoi passi riuscendo a compiere calcoli esatti, con un po’ di attenzione ma trovandoci tra le mani solo una serie di probabili posizioni in cui Ettore si trovava nello spazio di tempo ΔX in cui abbiamo rilevato matematicamente la sua velocità. Con le particelle funziona esattamente così. L’ultimo fenomeno che non possiamo tralasciare è l’entanglement (intreccio) che afferma che lo stato quantico di due sistemi è indissolubilmente legato allo stato di ciascun singolo sistema indipendentemente dalla distanza che intercorre fra essi, e qualunque valore osservabile uno dei due manifesterà l’altro sarà uguale ed opposto. Con un esempio cercherò di essere più chiaro: Ettore e Enrico (il suo corrispondente entangled per questo esempio, in onore di Fermi) sono legati nell’ipotetico sistema denominato “campo da calcio”, in cui essi sono collocati uno per porta e un muro di tre metri a centro campo impedisce loro di guardarsi e parlarsi. Qualunque movimento Ettore compirà, Enrico contemporaneamente lo imiterà in senso opposto, senza nessun tipo di comunicazione diretta (voce, vista, aiuto esterno) e c’è di più: la grandezza del campo da calcio potrebbe aumentare fino alle dimensioni di una galassia senza alcuna influenza sul fenomeno, purché restino validi i parametri del sistema “campo da calcio” a cui li abbiamo associati. Einstein ne fu così raccapricciato che dal momento in cui ne venne a conoscenza tentò di confutarne l’esistenza introducendo il concetto di variabili nascoste, ossia spiegazioni che al momento sfuggivano ai ricercatori costringendoli ad ammettere gli sconcertanti teoremi della meccanica quantistica, (famoso è l’esperimento mentale chiamato EPR dai nomi dei fisici Einstein, Podolski e Rosen). Non riuscirà nell’intento, venendo smentito nella teoria da Bell, negli anni ’60 e dalle prove sperimentali negli ultimi anni del XX secolo. Ad oggi l’entanglement è stato dimostrato in diverse occasioni ed è alla base dei futuri computer quantistici.
[hana-code-insert name=’adsense_link’ /]

7 – I “padri” della meccanica quantisitca: foto di gruppo dei 29 scienziati partecipanti alla V Conferenza di Solvay del 1927 presso l’Institut International de Physique Solvay in Leopold Park. Fu la più alta concentrazione di premi Nobel in un singolo luogo mai verificatasi.
In prima fila (dal basso) da sinistra: Irving Langmuir (Nobel per la chimica 1932), Max Planck (Nobel per la fisica 1918), Marie Skłodowska-Curie (Nobel per la fisica 1903 e per la chimica 1911), Hendrik Antoon Lorentz (Nobel per la fisica 1902), Albert Einstein (Nobel per la fisica 1921), Paul Langevin, Charles-Eugène Guye, Charles Thomson Rees Wilson (Nobel per la fisica 1927), Owen Willans Richardson (Nobel per la fisica 1928).
In seconda fila da sinistra: Peter Debye (Nobel per la chimica 1936), Martin Knudsen, William Lawrence Bragg (Nobel per la fisica 1915), Hans Kramers, Paul A.M. Dirac (Nobel per la fisica 1933), Arthur Compton (Nobel per la fisica nel 1927), Louis de Broglie (Nobel per la fisica (1929), Max Born (Nobel per la fisica 1954), Niels Bohr (Nobel per la fisica 1922).
In terza fila (in alto) da sinistra: Auguste Piccard, Émile Henriot, Paul Ehrenfest, Edouard Herzen, Théophile de Donder, Erwin Schrödinger (Nobel per la fisica 1933), Jules-Émile Verschaffelt, Wolfgang Pauli (Nobel per la fisica 1945), Werner Heisenberg (Nobel per la fisica 1932), Ralph H. Fowler, Léon Brillouin.
Note:
- Ruiz, Carme. “Salvador Dalí and Science.” El Punt [Girona] 18-10-2000. Fundació Gala-Salvador Dalí. Web. 3 Feb. 2013.
- “Nuclear Mysticism: Salvador Dali.” Tufts University. Web. 3-02-2013.
Bibliografia e fonti:
- Kumar, Manjit. Quantum: da Einstein a Bohr, la teoria dei quanti, una nuova idea della realtà. Milano: Mondadori, 2010.
- Rossetti, Cesare. Rudimenti di meccanica quantistica. Torino: Levrotto & Bella, 2011.
Immagini
- rappresentazione artistica © Silvio Dell’Acqua
- Brews ohare, 2012 [CC-BY-SA-3.0] Commons
- Salvador Dalí, 1952-1954. Fair use via Wikipaintings
- [PD] Smitshonian Library
- Maschen, [PD] Commons
- [PD] Fermilab
- 1927 [PD] Commons